


《微项目研究车用燃料及安全气囊—利用化学反应解决实际问题》化学键化学反应规律PPT
第一部分内容:必备知识·素养奠基
1.常见的汽车燃料
(1)燃料通常指能够将自身存储的_____能通过化学反应(燃烧)转变为___能的物质。
(2)自从汽车问世,汽车燃料经历了从___到_____的变迁。
2.汽车尾气污染及处理
(1)汽车尾气污染
是指由汽车排放的废气造成的环境污染。主要污染物为_____化合物、_____化物、一氧化碳、二氧化硫、硫化氢,以及微量的醛、酚、过氧化物等,能引起光化学烟雾等。
(2)汽车尾气处理
即汽车尾气由原有毒气体,变成无毒气体,再排放到大气中。从而可减少对大气环境的污染。采用催化剂:将CO氧化成___,碳氢化合物氧化成___和___,NOx被还原成__等。
3.汽车安全气囊气体发生剂
(1)特点
汽车安全气囊用的气体发生剂一般具有生成物_____、低_____、有毒组分含量___、产气量___、产气速度___等特点。
(2)常见气体发生剂种类
①成分:目前,用于汽车安全气囊的气体发生剂主要由_________、___________、_______等物质按一定比例混合而成。其氧化剂主要是_____。
②原理
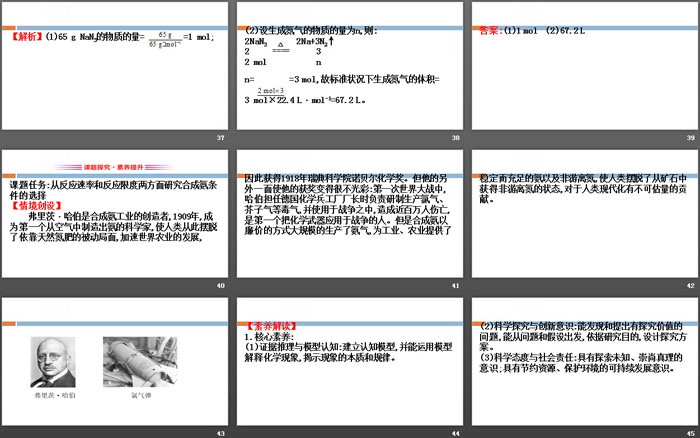
Ⅰ.汽车受到强烈撞击时,点火器点火引发叠氮化钠分解为氮气和金属钠。反应的化学方程式为___________________。
Ⅱ.硝酸铵吸收叠氮化钠放出的热量,生成一氧化二氮气体和水蒸气,反应的化学方程式为_______________________。
Ⅲ.三氧化二铁和钠反应,生成铁和氧化钠,反应的化学方程式为_______________________。
【情境·思考】
随着汽车应用的日益广泛,汽车尾气产生的污染越来越严重,汽车尾气的主要成分中包含的主要污染物有氮氧化物、一氧化碳、含铅化合物等。你知道这些污染物是如何产生的吗?
提示:氮氧化物是火花塞放电时空气中的氮气和氧气反应产生的;一氧化碳是汽油中碳元素不完全燃烧产生的;含铅化合物是汽油添加剂防爆剂燃烧后产生的。
... ... ...
微项目研究车用燃料及安全气囊利用化学反应解决实际问题PPT,第二部分内容:关键能力·素养形成
项目活动1:选择车用燃料
目前汽车所使用的燃料主要是汽油和柴油。而随着汽车保有量的逐年增加,汽车尾气排放造成的环境污染以及石油资源逐渐匮乏的问题已不容忽视,因此各种代用燃料也得到了越来越广泛的应用。目前国内开发使用的发动机代用燃料包括天然气、液化石油气、甲醇、乙醇、生物质燃料、氢气以及二甲基醚等。
(1)燃料燃烧是放热反应还是吸热反应?试用图象分析燃料燃烧过程中发生能量变化的本质原因。
提示:燃烧是放热反应,所以反应物能量大于生成物能量,图示如下:
(2) 请根据图示判断哪种燃料更适合作车用燃油?为什么?
提示:选择燃料A。因为A达到燃点所需要的能量少且放出的热量多。
(3)如何减少汽车污染对城市环境的危害?
提示:要减少汽车污染对城市环境的危害,最有效的办法是调整城市交通政策,大幅减少私家车数量,优先发展公交,提倡自行车交通;同时,还应加速发展、普及环保型汽车,减少对化石燃料的依赖。使用先进的汽车尾气处理技术,对不符合尾气排放标准的汽车进行淘汰或改造。定期清洗三元催化器,保持机动车尾气净化性能。汽车尾气中氮氧化物治理的方法之一是在汽车的排气管上装一个“催化转换器”。它的特点是使CO与NO反应,生成无毒气体。反应方程式:2CO+2NO 2CO2+N2。
【探究总结】
1.化学反应选择应遵循的原则
(1)从反应物的角度主要考虑:性质、状态、价格、安全性和原料的利用率的高低。
(2)从生成物的角度主要考虑:生成物是否有污染的副产物,与产物是否易分离。
(3)从反应条件的角度考虑:条件是否简便、节能。
(4)从操作的角度考虑:操作是否简便、易行。
2.六大工业尾气的主要成分
【迁移应用】
NOx是汽车尾气中的主要污染物之一。
(1)NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_____________________________________。
(2)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:
该反应是________(填“放热反应”或“吸热反应”)。
(3)在汽车尾气系统中安装催化转化器,可有效降低NOx的排放。
当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式:____________。
【解析】(1)NO2与H2O反应生成HNO3与NO;
(2)反应能量变化=945 kJ·mol-1+498 kJ·mol-1+2×
(-630) kJ·mol-1=+183 kJ·mol-1,反应为吸热反应。
(3)NO被CO还原为N2,CO被氧化为CO2。
项目活动2:设计安全气囊
安全气囊作为车身被动安全性辅助配置,越来越受到人们的重视。现代安全气囊系统由碰撞传感器、缓冲气囊、气体发生器及其控制系统等组成。
请查阅相关资料,尝试思考解决下列问题。
1.气体发生器中的物质应具有哪些性质?你能找到哪些符合要求的物质?
2.目前,叠氮化钠(NaN3)是在汽车安全气囊系统中普遍使用的物质之一。汽车受到猛烈碰撞时,点火器点火引发叠氮化钠迅速分解,产生氮气和金属钠,同时释放大量的热,如果你是设计师,你会同时在安全气囊系统中加入哪些其他物质?为什么?
... ... ...
微项目研究车用燃料及安全气囊利用化学反应解决实际问题PPT,第三部分内容:课题探究·素养应用
课题任务:从反应速率和反应限度两方面研究合成氨条件的选择
【情境创设】
弗里茨·哈伯是合成氨工业的创造者,1909年,成为第一个从空气中制造出氨的科学家,使人类从此摆脱了依靠天然氮肥的被动局面,加速世界农业的发展,因此获得1918年瑞典科学院诺贝尔化学奖。但他的另外一面使他的获奖变得很不光彩:第一次世界大战中,哈伯担任德国化学兵工厂厂长时负责研制生产氯气、芥子气等毒气,并使用于战争之中,造成近百万人伤亡,是第一个把化学武器应用于战争的人。但是合成氨以廉价的方式大规模的生产了氨气,为工业、农业提供了稳定而充足的氨以及非游离氮,使人类摆脱了从矿石中获得非游离氮的状态,对于人类现代化有不可估量的贡献。
【素养解读】
1.核心素养:
(1)证据推理与模型认知:建立认知模型,并能运用模型解释化学现象,揭示现象的本质和规律。
(2)科学探究与创新意识:能发现和提出有探究价值的问题,能从问题和假设出发,依据研究目的,设计探究方案。
(3)科学态度与社会责任:具有探索未知、崇尚真理的意识;具有节约资源、保护环境的可持续发展意识。
2.素养目标:
通过课题的探究学习,了解可逆反应概念及影响可逆反应速率和限度的因素。
【素养探究】
【探究一】从化学反应速率角度考虑合成氨条件的选择
1.合成氨工业的简要流程可用方框图表示为
(1)原料气的制取:合成氨的原料氮气和氢气一般通过什么途径获取?
(2)合成氨反应的方程式是N2(g)+3H2(g)
2NH3(g),反应为放热反应,请从反应速率的角度讨论应
采取什么样的条件更有利于氨气的快速生成?
提示:影响化学反应的因素有浓度、温度、压强和催化剂,速率越大越有利于氨气的快速生成,所以从速率的角度考虑应该采取高温、高压、加大氢气和氮气的浓度、加入催化剂提高反应速率。
【探究二】从化学反应限度角度考虑合成氨条件的选择
2.根据合成氨反应的方程式特点(N2(g)+3H2(g)
2NH3(g),反应为放热反应),试从反应限度的角度讨论以下问题:
(1)试从放热反应和吸热反应的角度讨论,高温还是低温有利于氨气的生成?
提示:反应是放热反应,低温时平衡正向移动,有利于氨气的生成。
(2)试从浓度的角度讨论如何改变能有利于氨气的生成?从经济性上考虑,应该让氢气的浓度大一点还是氮气的浓度大一点?
提示:增加反应物的浓度有利于平衡正向移动,减少生成物有利于氨气的生成,所以反应中应减少氨气的浓度。从经济性上考虑,氢气的价格比氮气贵,所以应适当增大氮气的浓度,增大氢气的转化率。
(3)从压强角度考虑,高压还是低压有利于氨气的生成?从技术和经济角度考虑,是不是压强越高越好?
提示:反应为气体体积减小的反应,所以加压平衡正向移动,有利于氨气的生成。如从技术和经济角度考虑,压强越高对设备的要求越高,会增加成本,所以并不是压强越高越好,要采取适当的高压。
(4)从催化剂角度考虑,是不是增加催化剂有利于氨气的生成?
提示:催化剂只能增加反应的速率,不能影响反应的限度,所以加入催化剂并不利于氨气的生成。
【探究三】合成氨实际条件的选择
(1)合成氨实际采取的温度在700 K左右,请综合反应速率、反应限度和催化剂等情况查阅资料说明原因。
提示:温度越高,反应速率越大,但不利于氨的合成,在实际生产中一般控制反应温度在700 K左右(且在此温度时催化剂的活性最大)。
(2)高压有利于合成氨反应速率和反应的限度,请讨论实际生产中应根据什么选择反应的压强?
提示:压强越大越有利于合成氨,但在实际生产中,应根据反应设备可使用的钢材质量及综合指标来选择压强,大致分为低压、中压和高压三种类型,一般采用高压。
(3)结合合成氨反应的速率和限度,查阅资料说明合成氨中氮气和氢气的最合适的比例是多少?反应中如何使生成的氨气分离出来?
提示:合成氨通常采用N2和H2物质的量之比为 1∶2.8 的投料比,并且及时将混合气体降低温度使氨气液化从反应混合物中分离出去。
(4)从节约原材料和提高平衡转化率的角度分析,反应后的混合气体应该如何处理?
提示:应循环利用,把反应后的气体通入反应容器继续反应。
【探究四】【迁移应用】
工业合成硫酸的示意图如下,其中最重要的一步反应是在接触室中发生的:
2SO2+O2 2SO3(反应为放热反应)。高压有利于三氧
化硫的生成,已知常压下二氧化硫的转化率就在百分之
九十以上,请问反应是否还需要高压?
【素养评价】
1.宏观辨识与微观探析—水平1:能从物质的宏观特征入手对物质及其反应进行分类和表征。
2.科学探究与创新意识—水平3:具有较强的问题意识,能提出探究的问题和假设,依据假设提出实验方案,独立完成实验。
3.证据推理与模型认知—水平4:能依据各类物质及其反应的不同特征寻找充分的证据,能解释证据与结论之间的关系。
4.科学探究与创新意识—水平4:能根据文献和实际需要提出综合性的探究课题,根据假设提出多种探究方案,评价和优化方案。
5.科学态度与社会责任—水平3:具有理论联系实际的观念,有将化学成果应用于生产、生活的意识,能依据实际条件并运用所学的化学知识和方法解决生产、生活中简单的化学问题。
关键词:鲁科版高中化学必修二PPT课件免费下载,微项目研究车用燃料及安全气囊利用化学反应解决实际问题PPT下载,化学键化学反应规律PPT下载,.PPT格式;
更多关于《 微项目研究车用燃料及安全气囊利用化学反应解决实际问题 化学键化学反应规律 》PPT课件, 请点击 微项目研究车用燃料及安全气囊利用化学反应解决实际问题ppt化学键化学反应规律ppt标签。